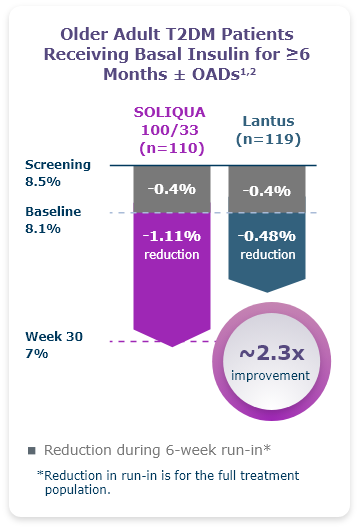
LixiLan-L Pivotal Data
LIXILAN-L

1.1% mean reduction in A1C from baseline for SOLIQUA 100/33 vs 0.6% for Lantus.1

Maria, 70
Retired
Not actual patient or profile.
Current treatment
- Metformin 1000 mg BID
- Insulin glargine U-100, 40 Units QHS
- Empagliflozin 25 mg QD
- Lisinopril 20 mg QD
- Atorvastatin 10 mg QD
- A1C: 8.9%
- FPG: 128 mg/dL
- PPG: 266 mg/dL
- BMI: 29 kg/m2
- Duration of diabetes: 11 years
- High blood glucose levels at 1-2 points during the day (~2 hours after meal); levels also slightly elevated at night (~9 pm)
- Previous episodes of hypoglycemia
- Previous nonadherence due to missed doses and multiple medications
- Concerned about co-pays/out-of-pocket costs
- Medicare Advantage Prescription Drug Plan
Physical & lab evaluation
Patient History
Insurance
LixiLan-L Pivotal Study
-
Para pacientes adultos con diabetes mellitus tipo 2 fuera de control con insulina basal como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, Soliqua 100/33 demostró una reducción de la A1C aproximadamente dos veces mayor que Lantus®1

Para pacientes adultos con diabetes mellitus tipo 2 fuera de control con insulina basal como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, Soliqua 100/33 demostró una reducción de la A1C aproximadamente dos veces mayor que Lantus®1

-
Para pacientes con A1C >9 %
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 alcanzaron el objetivo de A1C (<7 %) CON SOLIQUA 100/333,4*

Para pacientes con A1C >9 %
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 alcanzaron el objetivo de A1C (<7 %) CON SOLIQUA 100/333,4*

-
Para pacientes con A1C >9% como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 llegaron a menos del 7 % con SOLIQUA 100/333,4

Para pacientes con A1C >9% como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 llegaron a menos del 7 % con SOLIQUA 100/333,4

-
Para pacientes con A1C >9% como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 llegaron a menos del 7 % con SOLIQUA 100/333,4

Para pacientes con A1C >9% como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 llegaron a menos del 7 % con SOLIQUA 100/333,4

-
Para pacientes con A1C >9% como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 llegaron a menos del 7 % con SOLIQUA 100/333,4

*Documented symptomatic hypoglycemia defined as typical symptoms of hypoglycemia accompanied by an SMPG value of ≤70 mg/dL.2
Hypoglycemia is the most common adverse event with insulin-containing therapy.1
- From the pivotal trial data, severe symptomatic hypoglycemia for SOLIQUA 100/33 was 1.1% (4 out of 365 patients).1
- Severe symptomatic hypoglycemia defined as an event requiring assistance of another person to actively administer carbohydrates, glucagon, or other resuscitative actions.1
Para pacientes con A1C >9% como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, más pacientes con diabetes mellitus tipo 2 llegaron a menos del 7 % con SOLIQUA 100/333,4

*Documented symptomatic hypoglycemia defined as typical symptoms of hypoglycemia accompanied by an SMPG value of ≤70 mg/dL.2
Hypoglycemia is the most common adverse event with insulin-containing therapy.1
- From the pivotal trial data, severe symptomatic hypoglycemia for SOLIQUA 100/33 was 1.1% (4 out of 365 patients).1
- Severe symptomatic hypoglycemia defined as an event requiring assistance of another person to actively administer carbohydrates, glucagon, or other resuscitative actions.1
- From the pivotal trial data, severe symptomatic hypoglycemia for SOLIQUA 100/33 was 1.1% (4 out of 365 patients).1

Lidia, 46
Nurse
Not actual patient or profile.
Current treatment
- Metformin 1000 mg BID
- Lantus 35 units QD
- Olmesartan 40 mg QD
- Atorvastatin 10 mg QD
- A1C: 8.1%
- FPG: 118 mg/dL
- PPG: 242 mg/dL
- BMI: 33 kg/m2
- Duration of diabetes: 12 years.
- A1C continues to rise despite more than 12 months of treatment with basal insulin plus an OAD.
- Doctor prescribed using a CGM for 14 days and identified excursions in Lidia’s FPG and PPG levels.
- Is determined to lower her A1C because of concerns about her blood glucose levels, which show considerable intra-day variability.
- When considering new treatments, has concerns about hypoglycemia.
- PPO
Physical & lab evaluation
Patient History
Insurance
-
Para pacientes adultos con diabetes mellitus tipo 2 fuera de control con insulina basal como complemento de la dieta y el ejercicio
EN EL ENSAYO PIVOTAL LIXILAN-L, Soliqua 100/33 demostró una reducción de la A1C aproximadamente dos veces mayor que Lantus®1

- Se seleccionaron adultos con diabetes mellitus tipo 2, de 60 años en promedio, fuera de control con una dosis diaria estable de insulina basal, ±1 o 2 OAD (fármacos antidiabéticos orales) durante ≥6 meses (A1C de 7.5-10 %; glucosa en plasma en ayunas (FPG)[FPG] ≤180 mg/dL)
- Los pacientes elegibles (n = 1018) se inscribieron en un período de preinclusión de 6 semanas, en donde permanecieron o fueron cambiados al grupo de Lantus si recibían otra insulina basal, y cuya dosis se tituló/estabilizó mientras continuaban tomando metformina (si antes ya la tomaban). Todos los demás OAD se suspendieron.
- Los pacientes inadecuadamente controlados al final del período de preinclusión (n = 736; A1C entre 7 % y 10 %; FPG ≤140 mg/dL) y tratados con una dosis de insulina glargina de 20-50 unidades (dosis promedio de 35 unidades) fueron aleatorizados para recibir SOLIQUA 100/33 (n = 367) o Lantus (n = 369)
- El objetivo primario fue el cambio en la A1C desde el inicio hasta la Semana 30
- La dosis máxima de insulina glargina permitida fue de 60 unidades en ambos grupos de tratamiento
- El ensayo se diseñó para mostrar la contribución del componente GLP-1 RA a la reducción de la glucemia, y la dosis de insulina glargina y el algoritmo de dosificación se seleccionaron para aislar el efecto del componente GLP-1 RA
- Post Hoc Analysis Limitations: This study was not designed or powered to detect differences between treatments within this subgroup. The difference in effect observed in this subgroup analysis may not necessarily reflect the effect that will be observed in the care setting where alternative insulin glargine dosage can be used.2
Diseñado para evaluar la eficacia y la seguridad de SOLIQUA 100/33 frente a Lantus como complemento de la dieta y el ejercicio
En el ensayo clínico LixiLan-L, un total de 736 pacientes con diabetes mellitus tipo 2 (DMT2) participaron en un estudio multicéntrico aleatorizado, de diseño abierto, de 30 semanas, para evaluar la eficacia y la seguridad de SOLIQUA 100/33 en comparación con Lantus.

Cuando la A1c es alta, la ADA recomienda cambiar a una insulina basal más un GLP-1 RA* para reducirla2
The 2022 En las Guías de la ADA se recomiendan combinaciones inyectables iniciales, como insulina basal más un GLP-1 RA, cuando la A1C está ≥1.5 % por arriba del objetivo.
SOLIQUA 100/33 es una combinación de un análogo de la insulina humana de acción prolongada, con un agonista del receptor del péptido similar al glucagón 1 (GLP-1), indicada como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
Limitaciones de uso:
- No se ha estudiado en pacientes con antecedentes de pancreatitis. Se deben tener en cuenta otras terapias antidiabéticas en pacientes con antecedentes de pancreatitis.
- No se recomienda su uso en combinación con ningún otro producto que contenga un agonista del receptor del GLP-1.
- No es para el tratamiento de la diabetes mellitus tipo 1, ni de la cetoacidosis diabética.
- No se recomienda su uso en pacientes con gastroparesia.
- No se ha estudiado en combinación con insulina prandial.
Información De Seguridad Importante
Información de seguridad importante de SOLIQUA 100/33 (insulina glargina y lixisenatida), inyección de 100 unidades/ml y 33 mcg/ml
Contraindicaciones
- Durante episodios de hipoglucemia.
- En pacientes con hipersensibilidad seria a la insulina glargina, a la lixisenatida o a cualquiera de los componentes del producto.
Advertencias y precauciones
- Anafilaxia y reacciones de hipersensibilidad serias: En los ensayos clínicos con lixisenatida se han presentado casos de anafilaxia y otras reacciones de hipersensibilidad serias, como el angioedema. Las insulinas, incluida la insulina glargina, pueden producir reacciones alérgicas generalizadas graves y potencialmente mortales, como anafilaxia y angioedema. Se han reportado reacciones de hipersensibilidad serias, como reacciones anafilácticas y angioedema, en pacientes tratados con SOLIQUA 100/33. En caso de reacciones de hipersensibilidad, interrumpa la administración de SOLIQUA 100/33. Tenga precaución en pacientes con antecedentes de anafilaxia o angioedema con otros AR del GLP-1, pues se ignora si estarán predispuestos a la anafilaxia.
- Pancreatitis: Se ha observado pancreatitis aguda, incluida la pancreatitis hemorrágica o necrosante mortal y no mortal, en pacientes tratados con AR del GLP-1. Se reportaron casos de pancreatitis en ensayos clínicos con lixisenatida. Tras el inicio de SOLIQUA 100/33, observe a los pacientes para detectar signos y síntomas de pancreatitis (por ejemplo, dolor abdominal intenso y persistente, que a veces irradia a la espalda y que puede ir acompañado de vómito). Si se sospecha de pancreatitis, se deberá suspender inmediatamente la administración de SOLIQUA 100/33. Si se confirma la pancreatitis, no se recomienda reiniciar SOLIQUA 100/33 y deberán considerarse otros tratamientos antidiabéticos.
- No comparta nunca la pluma SoloStar® de SOLIQUA 100/33 entre pacientes: Compartir la pluma supone un riesgo de transmisión de patógenos de transmisión sanguínea, incluso si se cambia la aguja.
-
Hiperglucemia o hipoglucemia con cambios en el régimen de insulina: Los cambios en el régimen de insulina, por ejemplo, en potencia, fabricante, tipo, lugar de inyección o método de administración, pueden afectar el control glucémico y predisponer a hipoglucemia o hiperglucemia. Los cambios deberán hacerse con precaución y aumentando la frecuencia del monitoreo de la glucemia. Podría ser necesario ajustar el tratamiento antidiabético oral concomitante.
Las inyecciones repetidas de insulina en áreas de lipodistrofia o amiloidosis cutánea localizada pueden provocar hiperglucemia; se ha reportado que un cambio repentino de lugar de inyección (a un área no afectada) provoca hipoglucemia. Aconseje a los pacientes que cambien el lugar de inyección a zonas no afectadas y que estén muy atentos a la hipoglucemia.
- Errores de medicación: SOLIQUA 100/33 contiene dos fármacos. No administre más de 60 unidades de SOLIQUA 100/33, ya que puede producirse una sobredosis del componente lixisenatida. No use otros AR del GLP-1. Se han reportado confusiones accidentales entre productos de insulina. Indique a los pacientes que lean siempre la etiqueta antes de la administración. No extraiga el SOLIQUA 100/33 de la pluma con una jeringa.
- Hipoglucemia: La hipoglucemia es la reacción adversa más común asociada a la terapia con insulina, lo que puede poner en peligro la vida. dosis de insulina, medicamentos concomitantes para reducir la glucemia, programa de alimentación y actividad física, así como en pacientes con deficiencia renal o hepática y desconocimiento de la hipoglucemia.
- Lesión renal aguda: Se tienen informes de insuficiencia renal aguda y de agravamiento de la insuficiencia crónica, lo que en ocasiones puede requerir hemodiálisis en los pacientes tratados con SOLIQUA 100/33. Algunos de estos eventos se han reportado en pacientes sin ninguna enfermedad renal subyacente conocida. La mayoría de los informes provinieron de pacientes que experimentaron náuseas, vómito, diarrea o deshidratación; aconseje a los pacientes que tomen precauciones para evitar el agotamiento de líquidos. Vigile la glucemia y la función renal en los pacientes con deficiencia renal. SOLIQUA 100/33 no se recomienda en pacientes con enfermedad renal en fase terminal.
- Inmunogenia: Los pacientes pueden formar anticuerpos contra la insulina y la lixisenatida. En caso de deterioro del control glucémico o de incapacidad para lograr el control glucémico deseado, deberá pensarse en reacciones significativas o reacciones alérgicas en el lugar de inyección y considerar otra terapia antidiabética.
- Hipopotasemia: Todos los productos que contienen insulina pueden causar hipopotasemia, lo que puede poner en peligro la vida. La hipopotasemia no tratada puede causar parálisis respiratoria, arritmia ventricular y muerte. Vigile los niveles de potasio en los pacientes con riesgo de hipopotasemia y trátelos si está indicado.
- Retención de líquidos e insuficiencia cardíaca con el uso concomitante de agonistas de PPAR-gamma: Puede haber retención de líquidos con el uso concomitante de tiazolidinedionas (TZD) e insulina, lo que podría provocar insuficiencia cardíaca o agravarla. Estos pacientes deben ser observados para detectar signos y síntomas de insuficiencia cardíaca. En caso de insuficiencia cardíaca, debe considerarse una reducción de la dosis o la interrupción de la TZD.
- Enfermedad aguda de la vesícula biliar: Se han reportado casos agudos de enfermedad de la vesícula biliar, como colelitiasis o colecistitis, en ensayos con agonistas del receptor del GLP-1 y ensayos de poscomercialización. Si se sospecha de colelitiasis, está indicada la conducción de estudios de la vesícula biliar y un seguimiento clínico adecuado.
Reacciones adversas más frecuentes
Las reacciones adversas que se han reportado con mayor frecuencia en ≥≥5 % de los pacientes tratados con SOLIQUA 100/33 son: hipoglucemia, náuseas, nasofaringitis, diarrea, infección de las vías respiratorias superiores y dolor de cabeza
Interacciones con otros medicamentos
- Algunos fármacos pueden afectar al metabolismo de la glucosa, lo que hace necesario ajustar la dosis de SOLIQUA 100/33 y vigilar estrechamente la glucemia.
- Los signos de hipoglucemia pueden ser mínimos o ausentes en pacientes que reciben fármacos antiadrenérgicos (por ejemplo, beta-bloqueadores, clonidina, guanetidina y reserpina).
- La lixisenatida de SOLIQUA 100/33 retrasa el vaciado gástrico, lo que puede reducir la tasa de absorción de los medicamentos con razón terapéutica estrecha que se administran por vía oral o que requieren una cuidadosa supervisión clínica. Si dichos medicamentos deben administrarse con alimentos, no los administre de forma concomitante con SOLIQUA 100/33.
- Los antibióticos, el acetaminofeno (paracetamol) u otros medicamentos que dependen de concentraciones umbral para ser eficaces, o en los que no es deseable un retraso del efecto, deben administrarse al menos 1 hora antes de la inyección de SOLIQUA 100/33.
- Los anticonceptivos orales deben tomarse al menos 1 hora antes de la administración de SOLIQUA 100/33, u 11 horas después.
Haga clic aquí para ver la información de prescripción completa.
Haga clic aquí para obtener información sobre la eliminación de residuos médicos punzantes.
Abbreviations: ADA, American Diabetes Association; A1C, glycated hemoglobin; BID, twice per day; BMI, body mass index; CGM, continuous glucose monitor; FPG, fasting plasma glucose; GLP-1, glucagon-like peptide-1; OAD, oral antidiabetic drug; PPG, post-prandial glucose; QD, daily; QHS, every night at bedtime; RA, receptor agonist; SMPG, self-monitored plasma glucose; T2DM, type 2 diabetes mellitus.
Referencias:
- Información de prescripción de SOLIQUA 100/33.
- Pharmacologic approaches to glycemic treatment: standards of medical care in diabetes—2022. Diabetes Care. 2022;45(suppl 1):S125-S143.
doi:10.2337/dc22-S009 - Niemoeller E, Souhami E, Wu Y, Jensen KH. iGlarLixi reduces glycated hemoglobin to a greater extent than basal insulin regardless of levels at screening: post hoc analysis of LixiLan-L. Diabetes Ther. 2018;9:373-382. doi.org/10.1007/s13300-017-0336-6
- Datos en archivo. Additional Data A1C after run-in. July 2018.
- Davies MJ, Russell-Jones D, Barber TM, et al. Glycaemic benefit of iGlarLixi in insulin-naive type 2 diabetes patients with high HbA1c or those with inadequate glycaemic control on two oral antihyperglycaemic drugs in the LixiLan-O randomized trial. Diabetes Obes Metab. 2019;21:1967–1972. doi:10.1111/dom.13791
Información de seguridad importante de SOLIQUA 100/33 (insulina glargina y lixisenatida), inyección de 100 unidades/ml y 33 mcg/ml
Contraindicaciones
- Durante episodios de hipoglucemia.
- En pacientes con hipersensibilidad seria a la insulina glargina, a la lixisenatida o a cualquiera de los componentes del producto.
Advertencias y precauciones
- Anafilaxia y reacciones de hipersensibilidad serias: En los ensayos clínicos con lixisenatida se han presentado casos de anafilaxia y otras reacciones de hipersensibilidad serias, como el angioedema. Las insulinas, incluida la insulina glargina, pueden producir reacciones alérgicas generalizadas graves y potencialmente mortales, como anafilaxia y angioedema. Se han reportado reacciones de hipersensibilidad serias, como reacciones anafilácticas y angioedema, en pacientes tratados con SOLIQUA 100/33. En caso de reacciones de hipersensibilidad, interrumpa la administración de SOLIQUA 100/33. Tenga precaución en pacientes con antecedentes de anafilaxia o angioedema con otros AR del GLP-1, pues se ignora si estarán predispuestos a la anafilaxia.
- Pancreatitis: Se ha observado pancreatitis aguda, incluida la pancreatitis hemorrágica o necrosante mortal y no mortal, en pacientes tratados con AR del GLP-1. Se reportaron casos de pancreatitis en ensayos clínicos con lixisenatida. Tras el inicio de SOLIQUA 100/33, observe a los pacientes para detectar signos y síntomas de pancreatitis (por ejemplo, dolor abdominal intenso y persistente, que a veces irradia a la espalda y que puede ir acompañado de vómito). Si se sospecha de pancreatitis, se deberá suspender inmediatamente la administración de SOLIQUA 100/33. Si se confirma la pancreatitis, no se recomienda reiniciar SOLIQUA 100/33 y deberán considerarse otros tratamientos antidiabéticos.
- No comparta nunca la pluma SoloStar® de SOLIQUA 100/33 entre pacientes: Compartir la pluma supone un riesgo de transmisión de patógenos de transmisión sanguínea, incluso si se cambia la aguja.
-
Hiperglucemia o hipoglucemia con cambios en el régimen de insulina: Los cambios en el régimen de insulina, por ejemplo, en potencia, fabricante, tipo, lugar de inyección o método de administración, pueden afectar el control glucémico y predisponer a hipoglucemia o hiperglucemia. Los cambios deberán hacerse con precaución y aumentando la frecuencia del monitoreo de la glucemia. Podría ser necesario ajustar el tratamiento antidiabético oral concomitante.
Las inyecciones repetidas de insulina en áreas de lipodistrofia o amiloidosis cutánea localizada pueden provocar hiperglucemia; se ha reportado que un cambio repentino de lugar de inyección (a un área no afectada) provoca hipoglucemia. Aconseje a los pacientes que cambien el lugar de inyección a zonas no afectadas y que estén muy atentos a la hipoglucemia.
- Errores de medicación: SOLIQUA 100/33 contiene dos fármacos. No administre más de 60 unidades de SOLIQUA 100/33, ya que puede producirse una sobredosis del componente lixisenatida. No use otros AR del GLP-1. Se han reportado confusiones accidentales entre productos de insulina. Indique a los pacientes que lean siempre la etiqueta antes de la administración. No extraiga el SOLIQUA 100/33 de la pluma con una jeringa.
- Hipoglucemia: La hipoglucemia es la reacción adversa más común asociada a la terapia con insulina, lo que puede poner en peligro la vida. dosis de insulina, medicamentos concomitantes para reducir la glucemia, programa de alimentación y actividad física, así como en pacientes con deficiencia renal o hepática y desconocimiento de la hipoglucemia.
- Lesión renal aguda: Se tienen informes de insuficiencia renal aguda y de agravamiento de la insuficiencia crónica, lo que en ocasiones puede requerir hemodiálisis en los pacientes tratados con SOLIQUA 100/33. Algunos de estos eventos se han reportado en pacientes sin ninguna enfermedad renal subyacente conocida. La mayoría de los informes provinieron de pacientes que experimentaron náuseas, vómito, diarrea o deshidratación; aconseje a los pacientes que tomen precauciones para evitar el agotamiento de líquidos. Vigile la glucemia y la función renal en los pacientes con deficiencia renal. SOLIQUA 100/33 no se recomienda en pacientes con enfermedad renal en fase terminal.
- Inmunogenia: Los pacientes pueden formar anticuerpos contra la insulina y la lixisenatida. En caso de deterioro del control glucémico o de incapacidad para lograr el control glucémico deseado, deberá pensarse en reacciones significativas o reacciones alérgicas en el lugar de inyección y considerar otra terapia antidiabética.
- Hipopotasemia: Todos los productos que contienen insulina pueden causar hipopotasemia, lo que puede poner en peligro la vida. La hipopotasemia no tratada puede causar parálisis respiratoria, arritmia ventricular y muerte. Vigile los niveles de potasio en los pacientes con riesgo de hipopotasemia y trátelos si está indicado.
- Retención de líquidos e insuficiencia cardíaca con el uso concomitante de agonistas de PPAR-gamma: Puede haber retención de líquidos con el uso concomitante de tiazolidinedionas (TZD) e insulina, lo que podría provocar insuficiencia cardíaca o agravarla. Estos pacientes deben ser observados para detectar signos y síntomas de insuficiencia cardíaca. En caso de insuficiencia cardíaca, debe considerarse una reducción de la dosis o la interrupción de la TZD.
- Enfermedad aguda de la vesícula biliar: Se han reportado casos agudos de enfermedad de la vesícula biliar, como colelitiasis o colecistitis, en ensayos con agonistas del receptor del GLP-1 y ensayos de poscomercialización. Si se sospecha de colelitiasis, está indicada la conducción de estudios de la vesícula biliar y un seguimiento clínico adecuado.
Reacciones adversas más frecuentes
Las reacciones adversas que se han reportado con mayor frecuencia en ≥≥5 % de los pacientes tratados con SOLIQUA 100/33 son: hipoglucemia, náuseas, nasofaringitis, diarrea, infección de las vías respiratorias superiores y dolor de cabeza
Interacciones con otros medicamentos
- Algunos fármacos pueden afectar al metabolismo de la glucosa, lo que hace necesario ajustar la dosis de SOLIQUA 100/33 y vigilar estrechamente la glucemia.
- Los signos de hipoglucemia pueden ser mínimos o ausentes en pacientes que reciben fármacos antiadrenérgicos (por ejemplo, beta-bloqueadores, clonidina, guanetidina y reserpina).
- La lixisenatida de SOLIQUA 100/33 retrasa el vaciado gástrico, lo que puede reducir la tasa de absorción de los medicamentos con razón terapéutica estrecha que se administran por vía oral o que requieren una cuidadosa supervisión clínica. Si dichos medicamentos deben administrarse con alimentos, no los administre de forma concomitante con SOLIQUA 100/33.
- Los antibióticos, el acetaminofeno (paracetamol) u otros medicamentos que dependen de concentraciones umbral para ser eficaces, o en los que no es deseable un retraso del efecto, deben administrarse al menos 1 hora antes de la inyección de SOLIQUA 100/33.
- Los anticonceptivos orales deben tomarse al menos 1 hora antes de la administración de SOLIQUA 100/33, u 11 horas después.
Haga clic aquí para ver la información de prescripción completa.
Haga clic aquí para obtener información sobre la eliminación de residuos médicos punzantes.
Abbreviations: ADA, American Diabetes Association; A1C, glycated hemoglobin; BID, twice per day; BMI, body mass index; CGM, continuous glucose monitor; FPG, fasting plasma glucose; GLP-1, glucagon-like peptide-1; OAD, oral antidiabetic drug; PPG, post-prandial glucose; QD, daily; QHS, every night at bedtime; RA, receptor agonist; SMPG, self-monitored plasma glucose; T2DM, type 2 diabetes mellitus.
Referencias:
- Información de prescripción de SOLIQUA 100/33.
- Pharmacologic approaches to glycemic treatment: standards of medical care in diabetes—2022. Diabetes Care. 2022;45(suppl 1):S125-S143.
doi:10.2337/dc22-S009 - Niemoeller E, Souhami E, Wu Y, Jensen KH. iGlarLixi reduces glycated hemoglobin to a greater extent than basal insulin regardless of levels at screening: post hoc analysis of LixiLan-L. Diabetes Ther. 2018;9:373-382. doi.org/10.1007/s13300-017-0336-6
- Datos en archivo. Additional Data A1C after run-in. July 2018.
- Davies MJ, Russell-Jones D, Barber TM, et al. Glycaemic benefit of iGlarLixi in insulin-naive type 2 diabetes patients with high HbA1c or those with inadequate glycaemic control on two oral antihyperglycaemic drugs in the LixiLan-O randomized trial. Diabetes Obes Metab. 2019;21:1967–1972. doi:10.1111/dom.13791